Química general
Elementos, compuestos y mezclas
Los elementos en química son un tipo de materia formada por átomos de la misma categoría, estos son como los "bloques básicos" de todo lo que existe. Cada uno tiene un nombre y un símbolo en la tabla periódica.
Ejemplo: el oxígeno tiene como símbolo la letra "O", y en el caso del hierro es "Fe"
Los compuestos son como combinaciones de esos bloques. Cuando dos o más elementos se unen, forman algo nuevo, un compuesto.
Ejemplo: El agua (H₂O) es un compuesto hecho de hidrógeno (H) y oxígeno (O).
Las mezclas son la combinación de dos o más sustancias que no se transforman en algo nuevo, es decir, cada sustancia conserva sus propiedades originales. Estas se dividen en 2:
- Mezcla homogénea: Los componentes están tan bien mezclados que no puedes distinguirlos.
- Mezcla heterogénea: Los componentes se pueden ver o separar fácilmente.
Ejemplo: agua con azúcar, aire.
Ejemplo: ensalada, agua con aceite.
 Agua con aceite.
Agua con aceite.
Subíndices y coeficientes
En química, los subíndices son los números pequeños que se escriben justo al lado y abajo de un símbolo químico. Nos dicen cuántos átomos de ese elemento hay en una molécula.
Por ejemplo: en la fórmula del agua, H₂O, el "2" pequeño es el subíndice que nos dice que hay 2 átomos de hidrógeno en cada molécula de agua. Si no hay subíndice, significa que hay solo un átomo de ese elemento. Por ejemplo, en O (oxígeno), no hay subíndice, por lo que hay solo un átomo de oxígeno.
Los coeficientes son los números que se colocan antes de una fórmula química, y nos dicen cuántas moléculas o unidades de esa sustancia hay.
Por ejemplo: en 2H₂O, el "2" grande es el coeficiente, y nos indica que tenemos 2 moléculas de agua. Si no hay coeficiente, se asume que hay solo una molécula.
Resumen:
Subíndices: Muestran cuántos átomos de cada elemento hay en una molécula.
Coeficientes: Muestran cuántas moléculas de una sustancia hay.
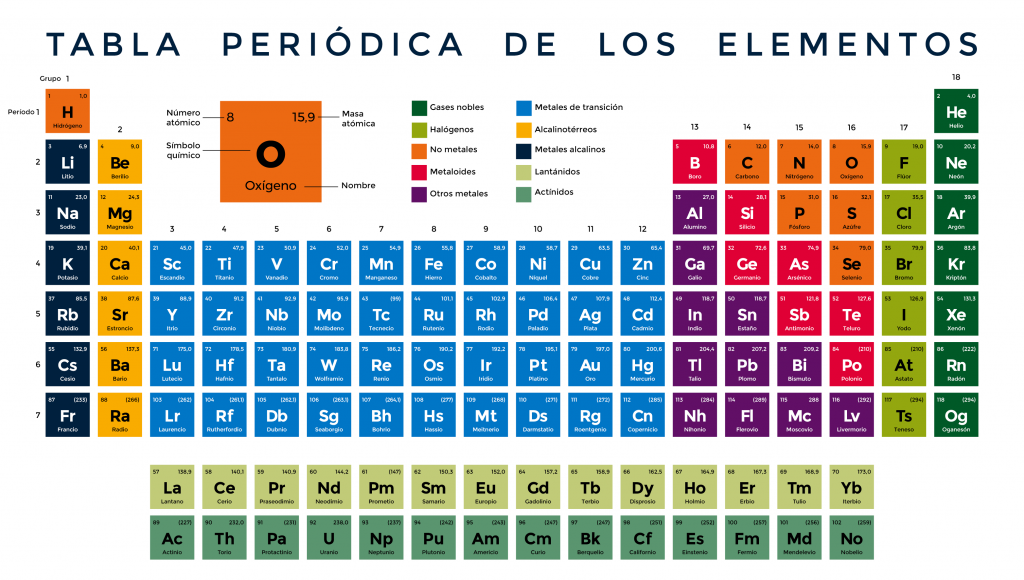
Tabla periódica
La tabla periódica de los elementos es una forma de representar los elementos químicos en forma de tabla, ordenados por su número atómico, por su configuración de electrones y sus propiedades químicas.
Historia y desarrollo
Mendeleev (1869): Fue el arquitecto de la tabla. Ordenó los elementos (los "ingredientes" del universo) según su peso y se dio cuenta de que algunos se repetían en patrones. Incluso dejó huecos para elementos que aún no se habían descubierto y ¡acertó!
Moseley (1913): Ajustó el diseño y propuso que lo importante no era el peso, sino el número de protones (número atómico). Su versión es la que usamos hoy.
Organización básica
- Grupos (columnas): Los elementos en una misma columna se comportan de manera parecida porque tienen la misma cantidad de electrones "externos" (como amigos que se visten igual). En total hay 18 grupos.
- Períodos (filas): Los elementos en una misma fila tienen capas de electrones similares (como pisos de un edificio). En total hay 7 períodos.
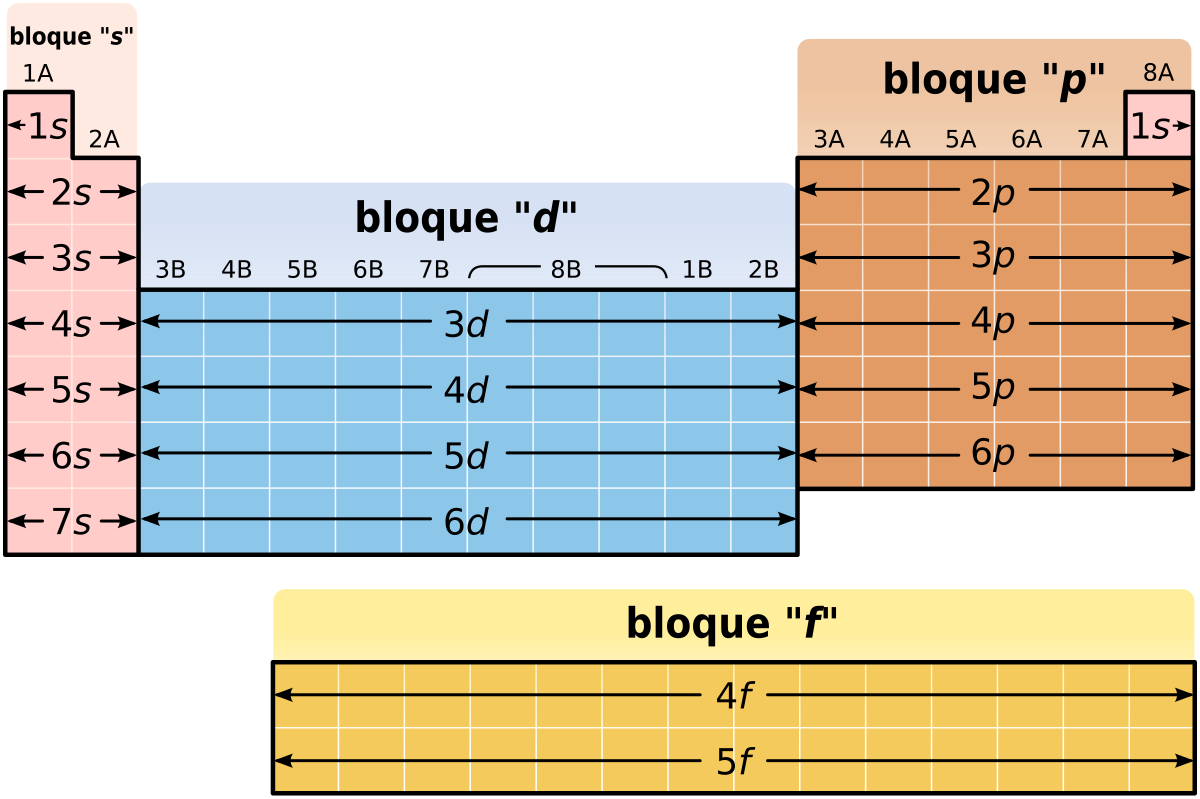
- Bloques: Es como dividir la tabla en zonas basadas en cómo se organizan los electrones. En total hay 4 bloques (s, p, d y f).
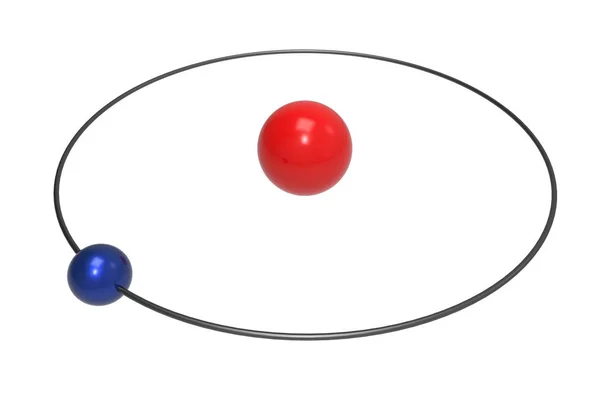
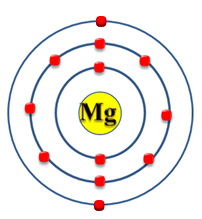
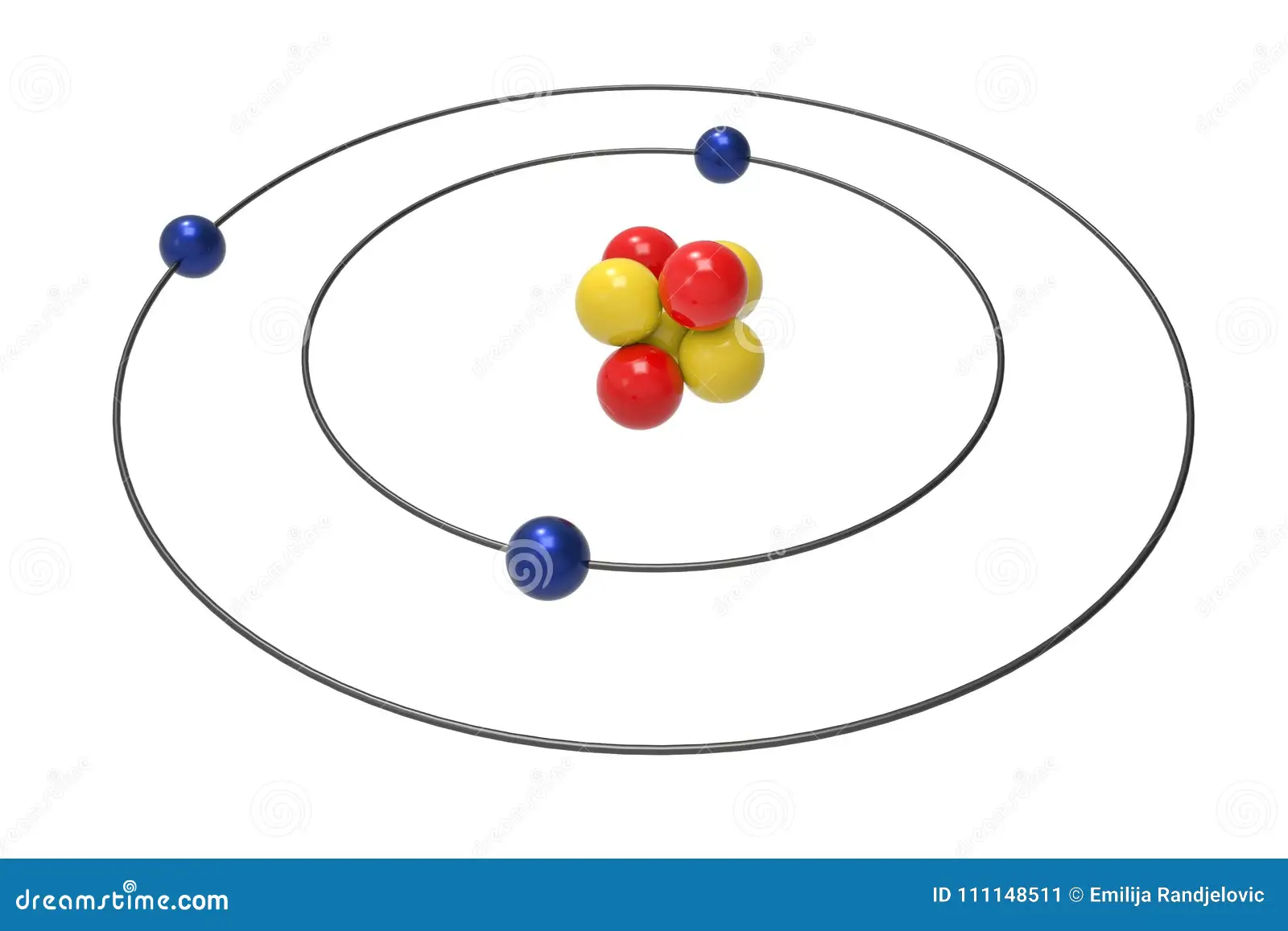 Se puede apreciar que la última capa solo posee un electrón, por ende, ambos átomo pertenecen al mismo grupo.
Se puede apreciar que la última capa solo posee un electrón, por ende, ambos átomo pertenecen al mismo grupo.
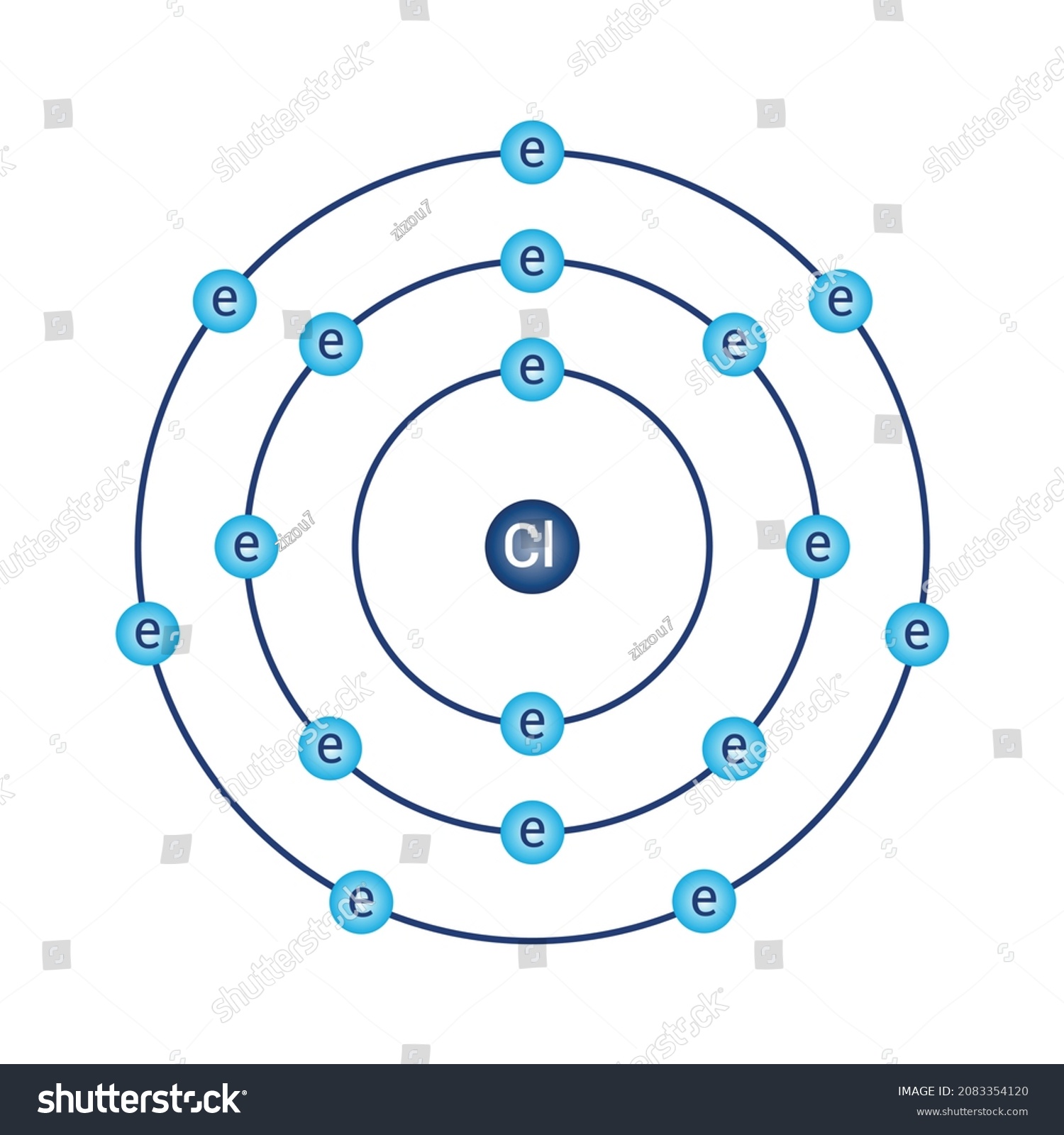
 Se puede apreciar cómo ambos átomos tienen la misma cantidad de capas, por ende, pertecen al mismo período.
Se puede apreciar cómo ambos átomos tienen la misma cantidad de capas, por ende, pertecen al mismo período.
Tipos de elementos
- Metales: Brillan, son buenos conductores de electricidad y calor, y son maleables (puedes darles forma).
- No metales: Son opuestos a los metales (sorpresa); muchos son gases o frágiles y no conducen electricidad.
- Metaloides (semi-metales): Son como una mezcla de los dos, a veces actúan como metales y otras como no metales.
Ejemplos: Hierro, cobre, platino, oro, etc.
 Oro
Oro
Ejemplos: Oxígeno, hidrógeno, cloro, carbono, etc.
 Azufre
Azufre
Ejemplos: Silicio, telurio, arsénico, antimonio, etc.
 Silicio
Silicio
Uso práctico
La tabla es una especie de "mapa mágico" que nos ayuda a saber lo siguiente:
- Cómo reaccionará un elemento.
- Si es un metal o un gas.
- Qué otros elementos pueden combinarse con él.
Enlaces químicos
Los átomos no quieren estar solos, así que se juntan formando enlaces. Existen 3 tipos de enlaces:
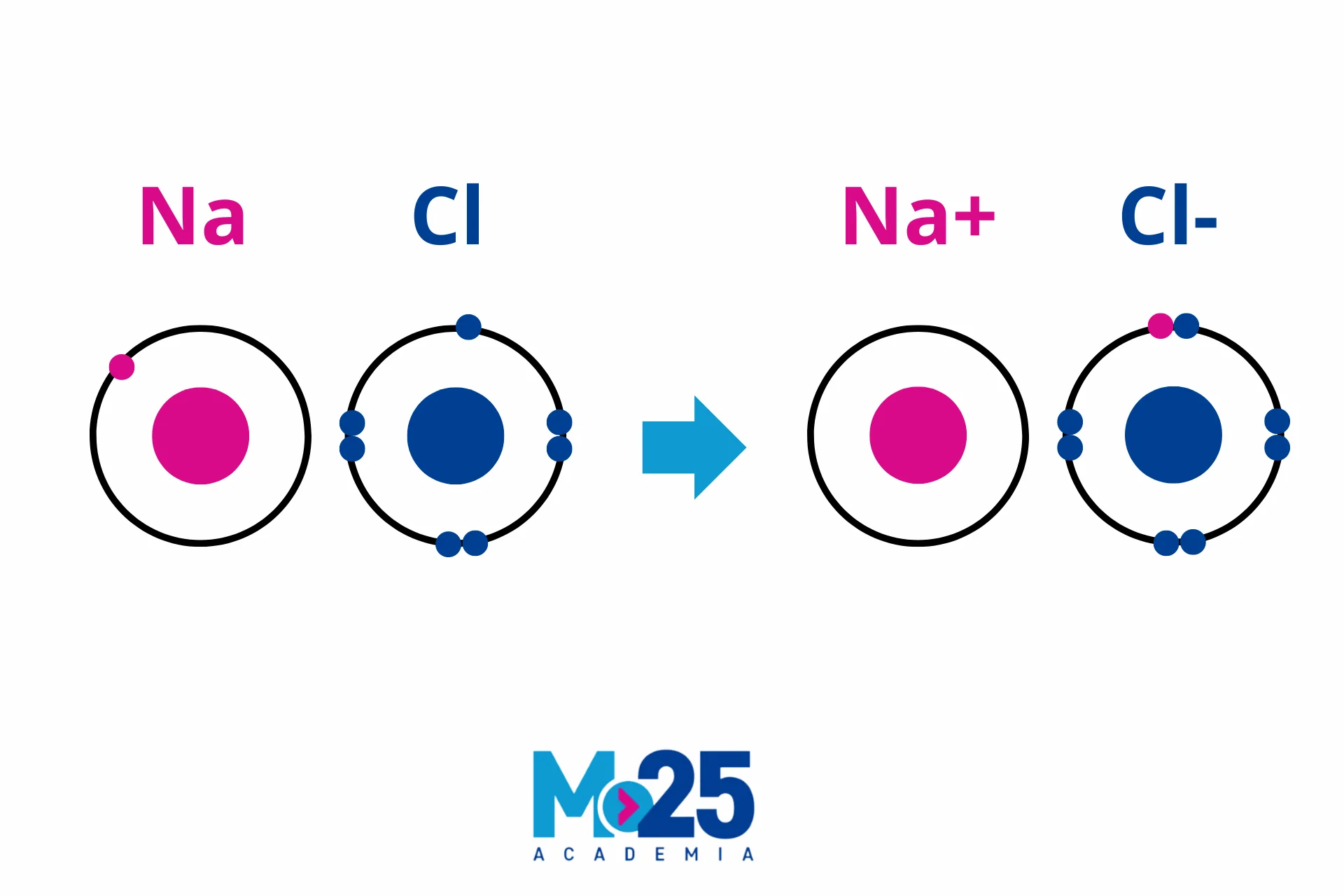
- Enlace iónico: Este enlace se produce únicamente entre 2 elementos de diferente tipo (un metal y un no metal). Uno de los átomos le "da" electrones al otro, como un amigo prestando un juguete.
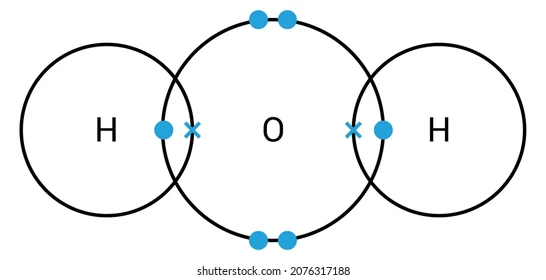
- Enlace covalente: Este enlace se produce únicamente entre 2 elementos no metálicos. Aquí, los átomos comparten electrones, como cuando dos amigos comparten un pastel.
- Enlace metálico: Este enlace se produce únicamente entre 2 elementos metálicos. Estos van compartiendo sus electrones los unos a los otros formando una estructura llamada "mar de electrones", como si se estuviera jugando a la papa caliente.
Ejemplo: La sal de mesa (NaCl) es un enlace entre sodio (metal) y cloro (no metal).
Ejemplo: El agua (H₂O) tiene enlaces covalentes.
Ejemplo:

Reacciones químicas
Una reacción química es como una receta de cocina: mezclas ingredientes (reactivos) y obtienes algo nuevo (productos). Existen 5 principales:
- Sintesis: Dos cosas se juntan para formar una sola.
- Descomposición: Algo se rompe en partes.
- Desplazamiento simple: Un elemento reemplaza a otro en un compuesto.
- Desplazamiento Doble: Dos compuestos intercambian partes (cationes y aniones) para formar dos nuevos compuestos. Es como si cambiaran de pareja.
- Combustión: Algo inflamable reacciona con oxígeno para producir fuego (energía y calor), agua y dióxido de carbono.
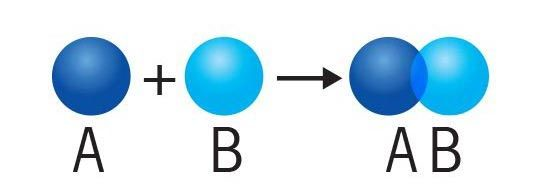

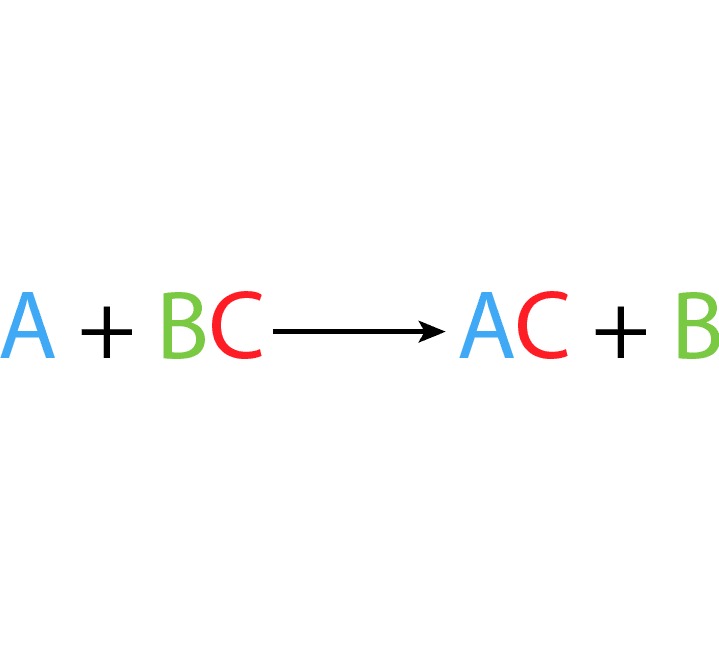
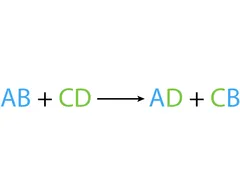

Electronegativad y polaridad
Imagina que los átomos son personas que comparten una cuerda (representa los electrones) en un tira y afloja.
Electronegatividad: Es qué tan fuerte un átomo "jala" la cuerda hacia sí. Algunos, como el oxígeno y el flúor, son muy fuertes porque les encanta atraer electrones. Otros, como el sodio, son más débiles.
Polaridad: Si un átomo jala la cuerda mucho más que el otro, el lado que tiene más cuerda (electrones) se vuelve un poco negativo, y el otro lado queda un poco positivo. Esto crea una molécula polar (como el agua). Si ambos jalan con la misma fuerza, no hay extremos positivos o negativos, y la molécula es no polar.
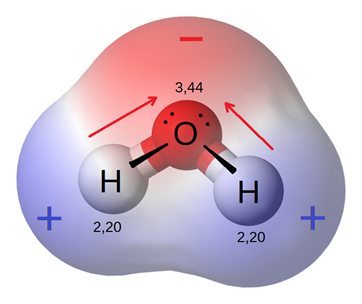 En esta imagen se puede ver cómo el oxígeno al compartir los electrones junto con el hidrógeno, la parte superior (donde está el oxígeno) se carga de forma negativa por todos los electrones combinados que hay en esa parte. Además, se puede apreciar cómo la parte de abajo (la de los hidrógenos) al casi no tener tantos electrones se carga de forma positiva.
En esta imagen se puede ver cómo el oxígeno al compartir los electrones junto con el hidrógeno, la parte superior (donde está el oxígeno) se carga de forma negativa por todos los electrones combinados que hay en esa parte. Además, se puede apreciar cómo la parte de abajo (la de los hidrógenos) al casi no tener tantos electrones se carga de forma positiva.
Ley de conservación de la masa
Esta ley dice que nada se pierde ni se gana, solo se transforma.
Ejemplo: Si quemas un papel, aunque se convierta en ceniza y gas, la cantidad total de materia sigue siendo la misma.
Ecuaciones químicas y balanceo
Una ecuación química es como una receta que muestra qué ingredientes (reactivos) se mezclan y qué productos se forman.
Ejemplo: Hidrógeno (H₂) + Oxígeno (O₂) → Agua (H₂O).
El balanceo asegura que no se pierda ni se cree materia de la nada (Ley de Conservación de la Masa).
Lo que entra (reactivos) debe ser igual a lo que sale (productos).
Cómo balancear: Cuenta los átomos de cada elemento a ambos lados de la flecha.
Ejemplo: H₂ + O₂ → H₂O
Lado izquierdo: 2 átomos de hidrógeno, 2 átomos de oxígeno.
Lado derecho: 2 H, 1 O.
Ajusta los numeros: Coloca coeficientes (números) delante de las fórmulas para que los átomos sean iguales de ambos lados.
Balanceado: 2H₂ + O₂ → 2H₂O
(Al agregar el coeficiente delante se está multiplicando por lo que le sigue, en este caso los 2 átomo de hidrógeno).Ahora hay: 4 atomos de hidrógeno y 2 atomos de oxígeno a ambos lados.
Si el tema no quedó muy claro, recomiendo ver los videos que se encuentran en la parte de Recursos
Estequiometría
Es una forma de calcular cuánto necesitas de cada sustancia para que una reacción química funcione perfectamente, sin que sobre ni falte nada.
Imagina que estás haciendo sándwiches: Por cada sándwich necesitas 2 rebanadas de pan y 1 rebanada de queso.
Si tienes 10 rebanadas de pan y 5 de queso, ¿cuántos sándwiches puedes hacer?
Relación: Por cada sándwich necesitas 2 panes y 1 queso.
Cálculo: Solo puedes hacer 5 sándwiches porque el queso se acaba primero.
Ahora con química:
2H₂ + O₂ → 2H₂O
2 moléculas de H₂ reaccionan con 1 molécula de O₂ para formar 2 moléculas de agua (H₂O).
Si tienes 4 moléculas de H₂ y 2 de O₂:
Relación: 2 H₂ necesitan 1 O₂.
Cálculo: Solo puedes usar 4 H₂ y 2 O₂ para hacer 4 H₂O.
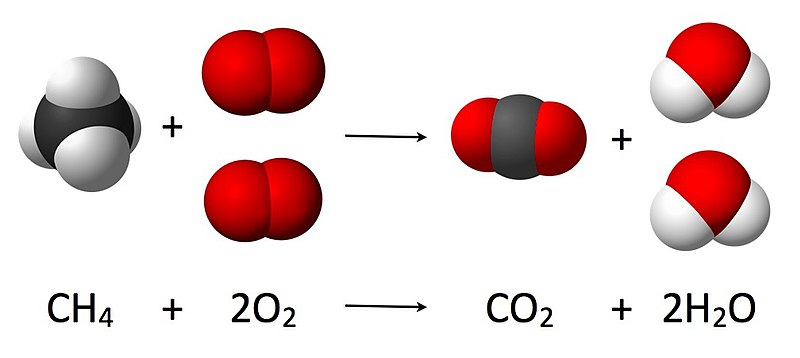 Reacción de Combustión
Reacción de Combustión
Resumen:
La estequiometría te dice:
Qué necesitas (reactivos).
Cuánto puedes producir (productos).
Qué sobra o falta.
Si el tema no quedó muy claro, recomiendo ver los videos que se encuentran en la parte de Recursos