Química inorgánica
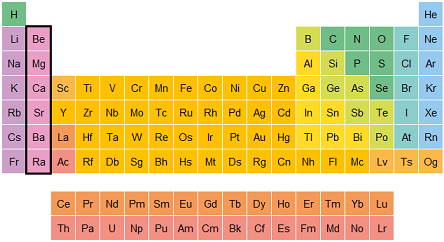
Propiedades periódicas
Son características de los elementos que cambian de forma predecible en la tabla periódica, como el tamaño de los átomos, su capacidad para formar enlaces y cómo reaccionan con otros elementos. Algunas son:
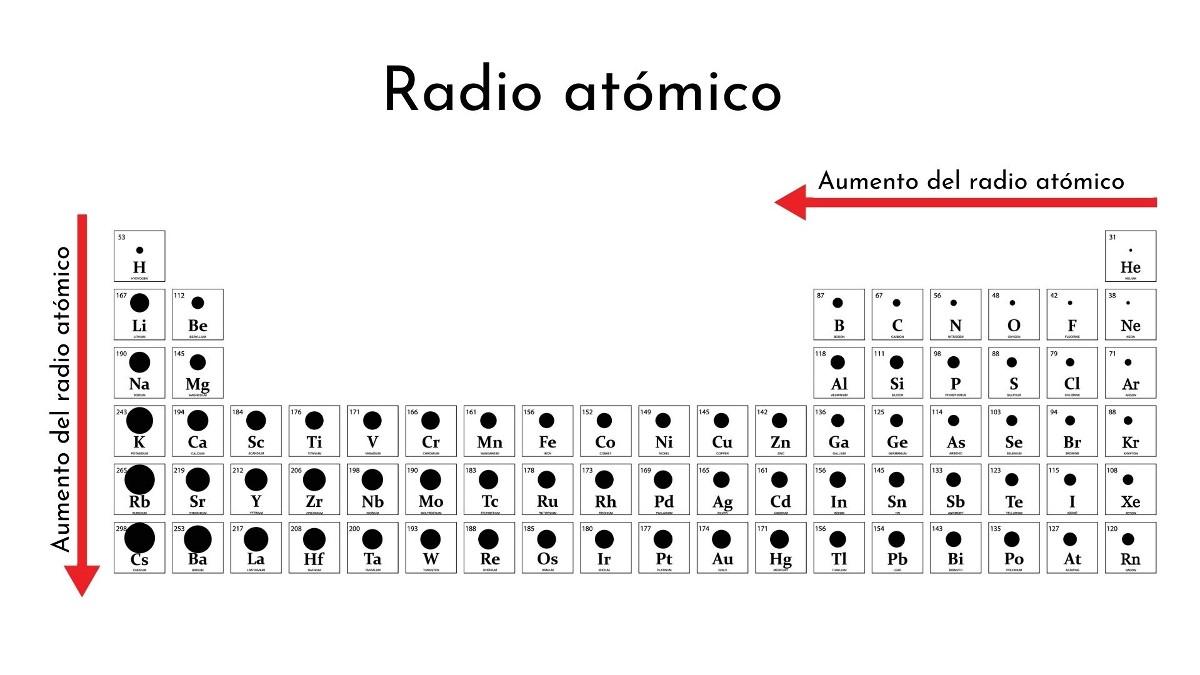
Radio atómico: Es el tamaño de un átomo. A medida que bajamos en un grupo de la tabla periódica, el tamaño aumenta, porque los átomos tienen más capas de electrones.
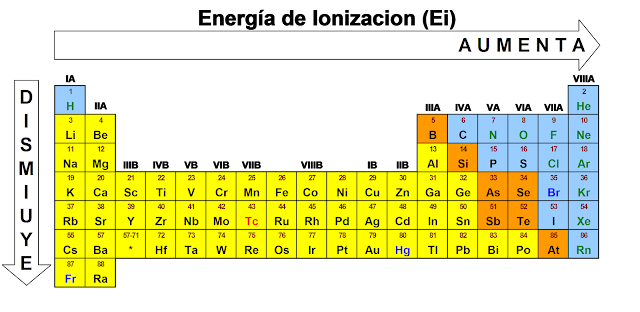
Energía de ionización: Es la energía necesaria para quitar un electrón a un átomo. Los elementos con pocos electrones en su capa externa tienen baja energía de ionización, mientras que los elementos con más electrones (cerca de los gases nobles) tienen alta energía de ionización.
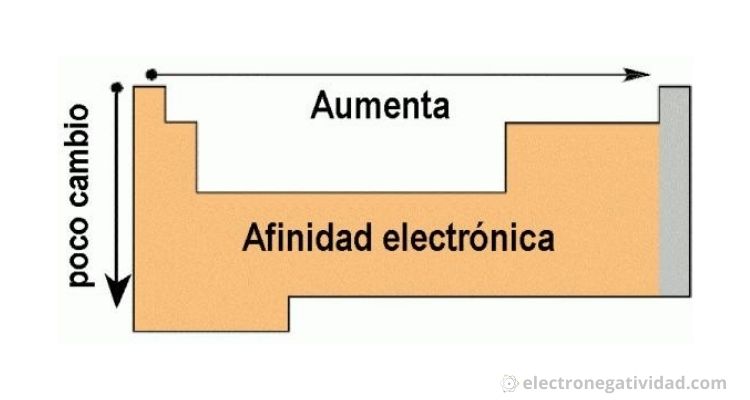
Afinidad electrónica: Es una medida de cuánto le gusta a un átomo ganar un electrón. Imagina que los átomos son como personas y los electrones son regalos. La afinidad electrónica es como si preguntaras: "¿Qué tan feliz está una persona cuando recibe un regalo?"
Grupos específicos de la tabla periódica
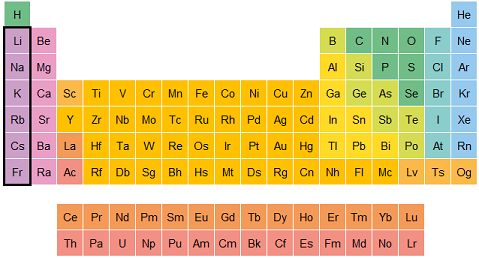
La tabla periódica está dividida en columnas llamadas grupos. Los elementos dentro de un grupo suelen compartir propiedades similares. Vamos a ver algunos grupos clave:
Grupo IA (Metales alcalinos): Son metales como el litio (Li), sodio (Na) y potasio (K). Son muy reactivos, especialmente con el agua. Se encuentran en el primer grupo de la tabla, por lo que siempre tienen un solo electrón en su capa exterior.
Grupo IIA (Metales alcalinotérreos): Son metales como el magnesio (Mg) y el calcio (Ca). Son menos reactivos que los metales alcalinos, pero todavía reaccionan con otras sustancias. Tienen dos electrones en su capa exterior.
Grupo VIIA (Halógenos): Son elementos como el flúor (F), cloro (Cl) y yodo (I). Son muy reactivos, especialmente con los metales, y tienen siete electrones en su capa exterior, lo que los hace querer "robar" electrones de otros elementos para completar su capa.
Grupo VIIIA (Gases nobles): Son elementos como el helio (He), neón (Ne) y argón (Ar). Son los "más tranquilos" de todos los elementos, ya que tienen su capa exterior llena de electrones, lo que hace que no necesiten reaccionar con otros elementos.
Metales de transición: Estos son los elementos que están en el medio de la tabla periódica, como el hierro (Fe), cobre (Cu) y oro (Au). Tienen propiedades muy variadas y son conocidos por ser buenos conductores de electricidad.
Elementos del bloque f (Lantánidos y actínidos): Son elementos que se encuentran en la parte inferior de la tabla periódica. Aunque son importantes, no se encuentran tan comúnmente en la naturaleza. Algunos, como el uranio (U), son radiactivos.
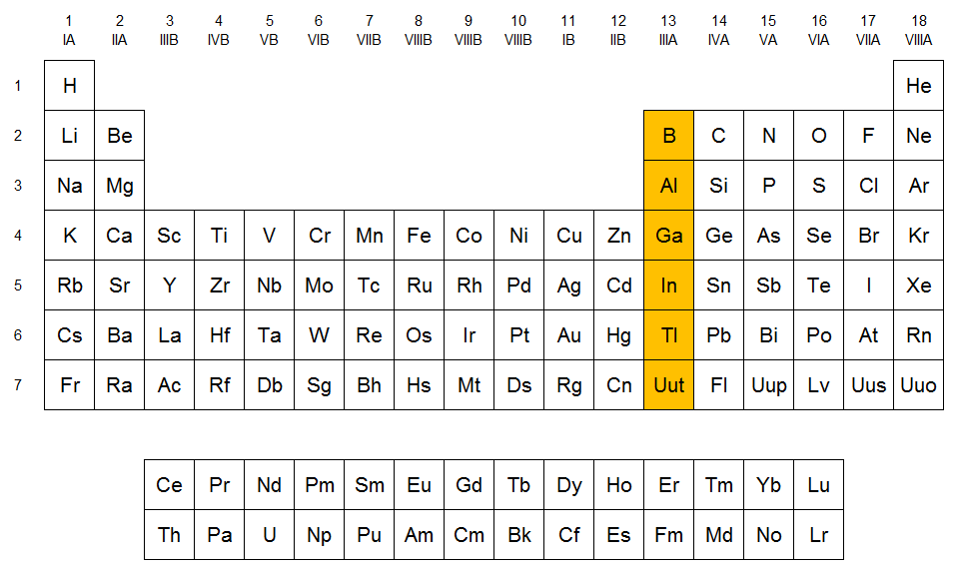
Grupo IIIA (Térreos): La característica del grupo es que los elementos tienen tres electrones en su capa más externa, por lo que suelen formar compuestos en los que presentan un estado de oxidación +3. El talio difiere de los demás en que también es importante su estado de oxidación +1.
Grupo VA (Nitrogenoides): Son elementos como el nitrógeno (N), fósforo (P) y Antimonio (Sb). Son muy reactivos a altas temperaturas, no reaccionan con el agua y reaccionan con ácidos oxidantes a excepción del nitrógeno
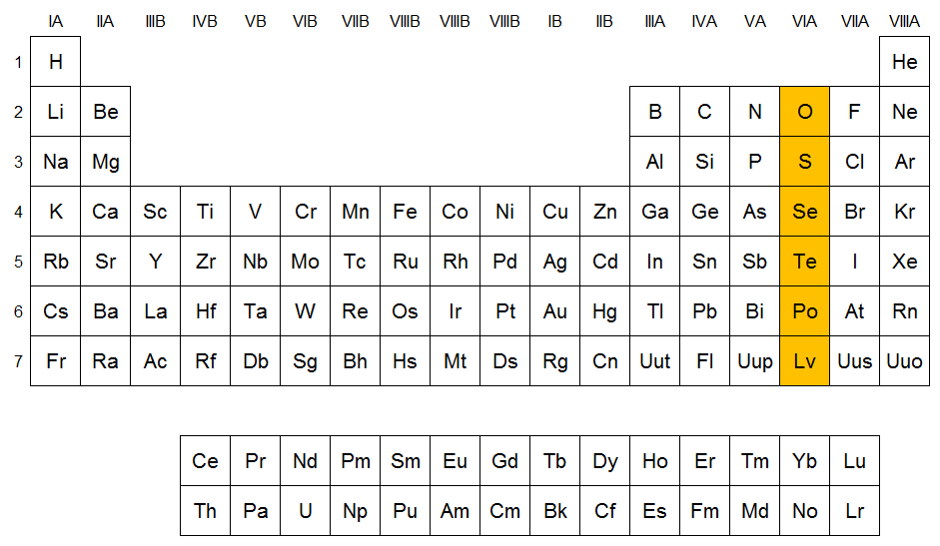
Grupo VIA (Anfígenos): Son elementos como el oxígeno (O), azufre (S) y Teluro (Te). Se presentan en diferentes formas moleculares, en los tres estados físicos, el carácter metálico aumenta del selenio al polonio y los estados de oxidación más usuales son -2, +2, +4 y +6.


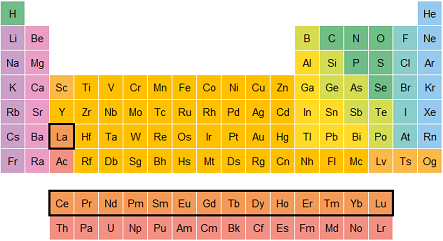 Lantánidos
Lantánidos
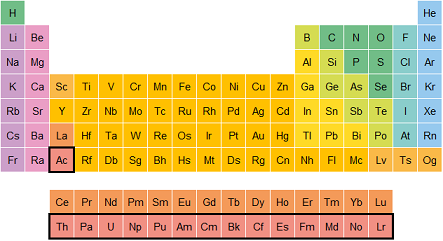 Actínidos
Actínidos
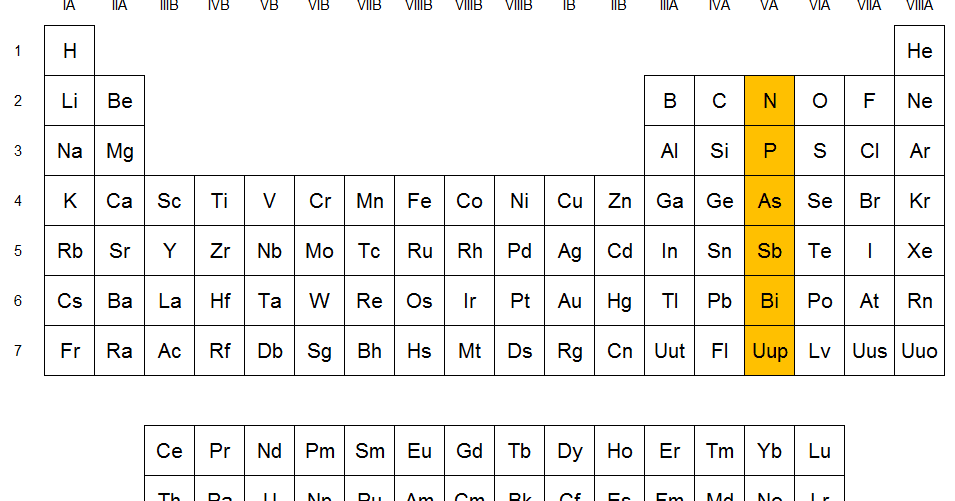
Nomenclatura química
La nomenclatura de compuestos inorgánicos se usa para nombrar sustancias químicas. Hay tres sistemas principales: IUPAC, tradicional y Stock. Aquí va una explicación clara y rápida:
IUPAC (sistemática)
Fórmula: [Prefijo + nombre del elemento]
Usa prefijos numéricos (mono-, di-, tri-, etc.) para indicar la cantidad de átomos de cada elemento.
Es precisa y universal.
Ejemplo:
CO₂ → Dióxido de carbono
PCl₅ → Pentacloruro de fósforo.
Nomenclatura Tradicional
Fórmula: [Raíz del elemento + sufijo]
Depende de la valencia del elemento (metales y no metales).
Sufijos comunes:
- -oso → Menor valencia.
- -ico → Mayor valencia.
Prefijos comunes:
- Hipo- → Menor valencia.
- Per- → Mayor valencia.
FeCl₂ → Cloruro ferroso (Fe con valencia +2).
FeCl₃ → Cloruro férrico (Fe con valencia +3).
Indica la valencia con números romanos.
Cu₂O → Óxido de cobre(I) (valencia +1).
CuO → Óxido de cobre(II) (valencia +2).
Ejemplo:
Nomenclatura de Stock
Fórmula: [Nombre del elemento + número romano de la valencia]
Ejemplo:
A la hora de nombrar compuestos, los nombres pueden tener una que otra característica la cual se añade al nombre, esto depende de la combinación del elemento. A continuación se verán estos casos (para evitar confusiones o más dolores de cabeza, se utilizará exclusivamente el sistema IUPAC en el resto de esta página):
Hidrácidos
Son ácidos sin oxígeno.
Fórmula general: [H + no metal].
Nombre: Ácido + raíz del no metal + -hídrico.
Ejemplo:
HCL → Ácido clorhídrico.
HF → Ácido fluorhídrico.